研究内容
生化学研究室では主に下記のようなテーマについて研究を行っています。
クロマチン制御機構に関する研究
ヒトの細胞一つに収納されている染色体DNAは伸ばすと約2メートルに及ぶといわれています。この長いDNAが直径わずか10ミクロンの核に収納されるためには、クロマチン構造を形成することが必要です。クロマチンはコアヒストンの周りに147塩基対のDNAが巻き付いたヌクレオソームを一つの単位として形成され、リンカーヒストンやその他多くのクロマチンタンパク質が結合することによって高度に凝縮しています。私たちの研究室では、ヒストンの動態を制御する
ヒストンシャペロン を同定して(Okuwaki M. et. al, JMB, 2001)、その機能解析を行ってきました。染色体の構造がどのように安定に形成されるのか、遺伝子発現とどのように関連するのか、といった疑問を解決すべく研究を行っています。我々が研究を進めているTAF-I、NPM1、NAP1といったヒストンシャペロンは、体細胞におけるクロマチン制御に加えて、
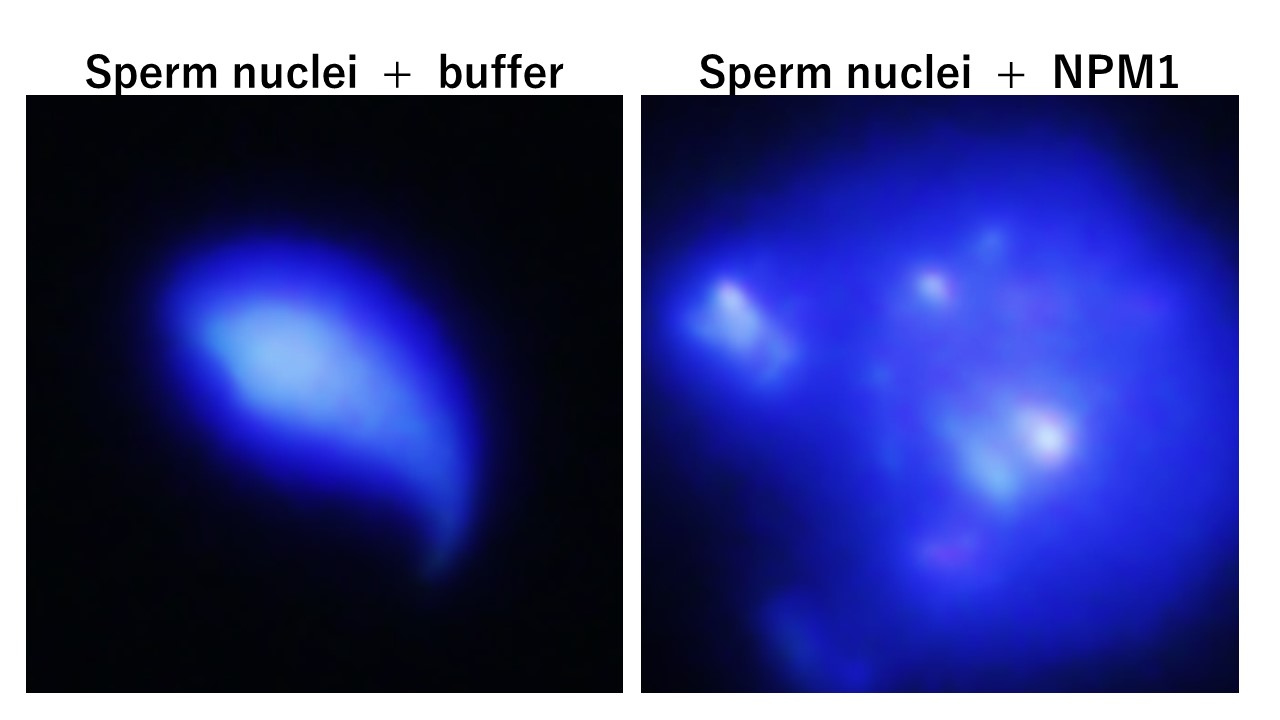
精子核クロマチン のリモデリングにも重要な役割を担うことが示唆されています(Okuwaki et. al., NAR, 2012)。これらの研究は、受精後のクロマチン動態の変化、精子クロマチン構造形成の仕組みの解明にも取り組んでいます。
核小体の構造と機能に関する研究
核小体は細胞核に形成される核内構造体です。核小体の機能は主にタンパク質翻訳装置であるリボソームを合成することです。リボソームは18S、5.8S、28S、5Sの4種類のリボソームRNA(rRNA)と80種類のリボソームタンパク質からなる巨大複合体です。18S、5.8S、28S
rRNAは1本の前駆体rRNAとしてRNAポリメラーゼIによって核小体の中で合成され、様々なRNA結合タンパク質、RNA修飾因子の助けを借りて3種類のrRNAに成熟します。5S
rRNAは核小体の外でRNAポリメラーゼIIIによって合成され、核小体にはこばれ、リボソームに取り込まれます。 リボソームは細胞を増殖するためのタンパク質合成に関わるため、がん細胞や幹細胞など増殖の活発な細胞では、リボソーム合成速度が速く、核小体も肥大化していることが知られています。したがって、核小体は細胞の
がん 化や幹細胞の 未分化性維持 など、疾患とのかかわりも示唆されています。さらに、リボソーム合成は細胞のエネルギーの多くを消費する反応であることから、細胞のエネルギー状態を検知する機能があると考えられており、この機能が
細胞の 老化 と密接にかかわることが明らかになってきました。 個体の 老化 は種を超えて見られる 生命現象ですが、その仕組みはよくわかっていません。核小体の構造と機能の解明を通して、がんをはじめとする疾患の原因や細胞老化の仕組みの解明に取り組んでいます(Ueshima
et. al., MCB, 2017)。
がん悪性化の分子基盤に関する研究
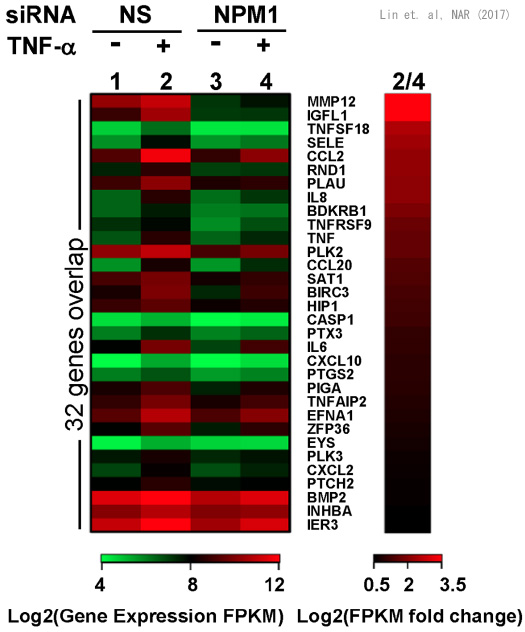
これまでの研究からクロマチン制御に関わるヒストンシャペロンの機能を明らかにしてきました。ヒストンシャペロンはヒストンと直接相で互作用して、その非特異的DNA結合を抑制すること、クロマチン構造形成を促進すること、クロマチンからヒストンを除くことなどの活性を有します。最近の研究から、我々が同定したヒストンシャペロンが、転写因子と直接結合しその機能制御に関わることが明らかになりました。ヒストンシャペロンNPM1は、転写因子Nuclear
Factor kapp B (NFkB)のDNA結合領域に直接結合し、DNA結合活性を促進することを見出しました。NFkBは 炎症応答 、 免疫応答
に重要な転写因子であることから、NPM1はNFkBを介した炎症を介した細胞のがん化促進機能を有する可能性が示唆されます(Lin et. al.,
NAR, 2017)。NPM1はがん細胞で発現亢進していることから、NFkBの機能促進を通してがん細胞の転移にもかかわることが示唆されます。NPM1はNFkBのみならずいくつかの免疫応答の転写因子との相互作用も見出されており(Abe
et. al., FEBS Letters、2018)、炎症応答や感染応答の場で起こる転写制御機構の解明に向けて研究を行っています。
プロテオミクス技術を用いたシグナル伝達機構に関する研究
がんなどヒトのさまざまな疾患は細胞の増殖を制御するシグナル伝達系の異常の結果です。生化学研究室では、細胞内シグナル伝達系の全貌をプロテオミクス技術をもちいて可視化することを目指しています。わたしたちは、細胞の中で、細胞増殖のシグナルを伝えるシグナル伝達系の構成要素を研究しています。
がんや糖尿病 など多くの疾患がこの系の異常に起因しているからです。その中でも、特に重要と考えられている、タンパク質リン酸化に焦点をあて、細胞を刺激した時や、細胞が異常になった時に、どのようにリン酸化のパターンが変化するかを調べています。
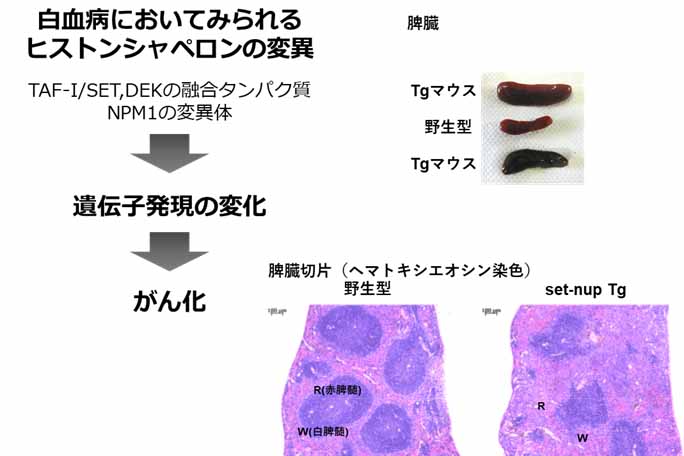
白血病発症機構に関する研究
遺伝子発現の調節は、転写、スプライシング、mRNAの核外輸送など様々なステップで厳密にコントロールされており、それらの破綻ががんを引き起こすことがあります。ヒストンシャペロンの中には、がん細胞で変異型を発現しがん化に関わっているものがあります。私たちはそのようなタンパク質を介した発がん機構の解析を行っています(Saito
et. al., MCB, 2016) 。 ヒストンシャペロンの一つであるTAF-Iの融合遺伝子産物を発現するトランスジェニック(Tg)マウスでは血球分化の抑制が起こり、脾臓の肥大化が見られました。どのようなメカニズムで分化抑制が起きたのか、分子レベルで明らかにしたいと考えています。
抗感染症薬の開発
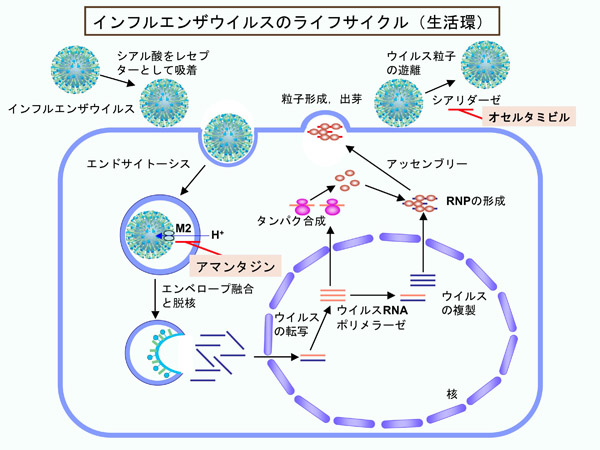
生化学研究室では、柴垣芳夫講師を中心として、微生物薬品製造学教室との共同研究により、あらたなウイルス因子を標的とする、 抗インフルエンザ薬 の創製を目指しています。インフルエンザウイルスは感染後、核内で複製し、mRNAを合成します。その際に、mRNAのCap構造を合成できないので、宿主細胞のmRNAからCap部分を切り出し、その3'側に自身のmRNAを合成します。このCap-snatching反応と呼ばれる反応は、ウイルスに特異的であり、宿主細胞には存在しないことから、新規の抗ウイルス薬の標的として適切なものです。生化学研究室では独自にCap-snatching反応評価系を開発し、この反応系を用いて、薬剤スクリーニングを行っています。