

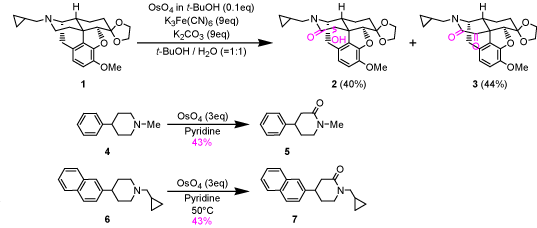
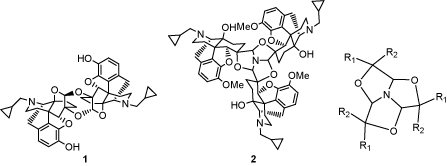
オピオイド受容体選択的リガンド創製の過程において四酸化オスミウムを用いた新規酸化反応を発見したのでその一般性の検討を行っている。すなわち化合物1に四酸化オスミウムを用いて反応を行うと、ヒドロキシルアミド体2とケトアミド体3が主生成物として得られる。第3級アミンがアミドに酸化されたという報告例はなく、この結果はアミンからアミドへ変換する新規酸化反応の発見であると考え、この反応の検討を行った。また、N-アルキル-4-アリールピペリジン4および6を用いて反応の一般性も確認した。
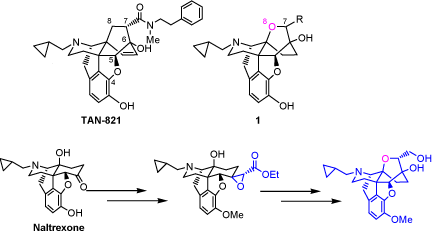
我々はこれまでにオピオイドε受容体選択的作動薬TAN-821を見出したが、in vitroにおけるタイプ選択性が完全ではない。その原因としてTAN-821の高い脂溶性に起因する受容体との強い疎水結合が考えられる。そこで、我々はTAN-821の母核であるビシクロ[2.2.2]オクテン構造中に酸素原子を導入し親水性を高めたオキサビシクロ[2.2.2]オクタン骨格を有する化合物を設計し、合成に着手した。 オピオイドμ受容体拮抗薬Naltrexoneを原料に用い、Darzens condensationをkey stepとしてオキサビシクロ[2.2.2]オクタン骨格を構築した。続いて選択性を向上させるための7位側鎖の導入しさらにε受容体選択性の高いリガンドの合成を行っている。
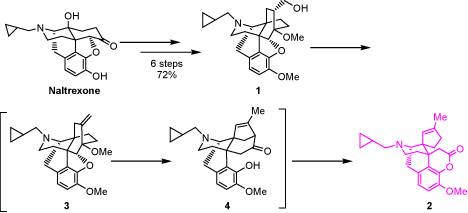
オピオイド受容体選択的リガンドの創出を試みる過程で、ベンゾモルファン骨格を有する新規化合物2を合成した。ナルトレキソンを出発物質とし、6段階、総収率72%でアルコール体1を得た。これをジクロロメタン中、トリフルオロメタンスルホン酸無水物存在下、室温で撹拌した後濃縮し、得られた残渣をトルエン中で還流したところ、ラクトン体2が収率77%で得られた。ラクトン体2の生成機構は、3、4を反応中間体とする経路が推定されている。興味ある人は上記反応の機構を考えて下さい。
これまでにμ拮抗薬であるナルトレキソンを原料として、ダイマー構造を有するκ拮抗薬のnor-BNIが合成されている。メッセージアドレス概念を用いると、側鎖をC環上部に固定すればε受容体選択的リガンドが得られると考え、ダイマー1を設計し合成した。その過程においてトリマー2が生成することを見出した。このトリマー合成法はモデル化合物においても適応することができ、この方法を用いたトリマーリガンド及びトリマー試薬の開発を行っている。本トリマーは非対称のものも合成でき、モノマーの活性向上と2つの受容体や酵素と同時に結合できるデュアルリガンドとしても設計可能である。
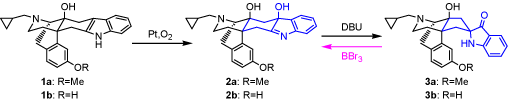
我々は高いオピオイドδ受容体選択性及びδサブタイプ選択性を有する化合物の合成を目的とした研究を行っている。その過程で、インドロモルヒナン誘導体1を白金触媒酸化反応によりインドレニン誘導体2aへと酸化し、続く塩基を用いた転位反応により、スピロ化合物3aへと導いた。このスピロ化合物3aを三臭化水素で処理したところ、元のインドレニン骨格を有する化合物2bへ戻るという、新しい知見が得られた。この転位反応は未だ報告されておらず、種々のルイス酸の中でBBr3・BCl3等のホウ素含有ルイス酸を用いた場合のみ両化合物の骨格変換が可能となることを見出した。
第52回日本薬学会関東支部大会優秀研究発表賞受賞
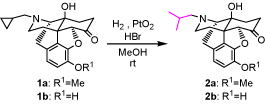
シクロプロパン環は高度に歪んでいるが、共役系により活性化されていない場合は、一般に還元的開環反応には比較的安定であり、シクロプロパン環の還元的開環反応には高温高圧下の条件が必要となる。オピオイドμ受容体拮抗薬であるナルトレキソン誘導体1を用いて臭化水素酸存在下、酸化白金を触媒とすると、常温常圧という温和な条件下で、共役系により活性化されていないにも関わらず、N-シクロプロピルメチル基を還元的に開環し、カルボニル基をほとんど還元することなくイソブチル基へと選択的に変換できることを見出した。
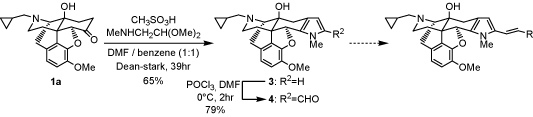
ナルトレキソン誘導体 1aからピロール環 3を収率良く合成する方法を見出し、4とした。これまでピロール環に側鎖を導入し、κオピオイド受容体選択的リガンドである化合物を合成して薬理活性試験を行ってきた。今後も、様々な側鎖を導入した新規ピロール誘導体を合成し、結合実験および拮抗活性、作動活性についての薬理活性試験を行っていく予定である。
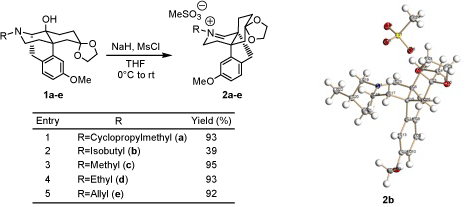
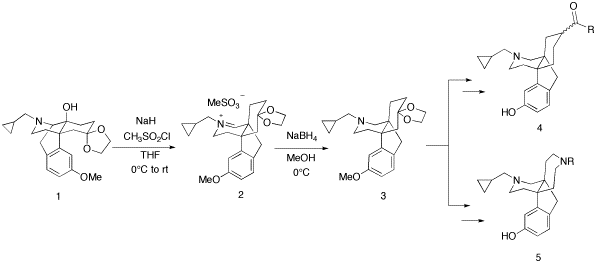
我々は14-ヒドロキシモルヒナン誘導体1a-eにTHF中、NaH及びMsClを作用させると安定なイミニウム塩2a-eが得られることを見い出した。一般的に、イミニウム塩は不安定な化合物であるが、2a-eは非常に安定であり、シリカゲルカラムクロマトグラフィー (MeOH-CHCl3) で精製可能である。さらに、窒素置換基としてイソブチル基を有するイミニウム塩2bは結晶化し、そのX線結晶構造解析によって2bのイミニウム構造が確認された。また、2をNaBH4で還元するとプロペラン型化合物が得られ、現在はオピオイドδ及びκ受容体をターゲットとしたプロペラン型オピオイドリガンドの創製を行っている。
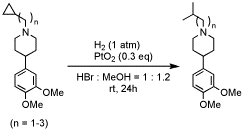
シクロプロパン環は高度に歪んでいるが、共役系により活性化されていない場合は、一般に還元的開環反応は高温高圧下の条件が必要になる。しかし、共役系により活性化されていないシクロプロパン環に対して、臭化水素酸存在下、PtO2を触媒に用いると、常圧の水素雰囲気下室温という温和な条件で、N-シクロプロピルメチル基、N-シクロプロピルエチル基及びN-シクロプロピルプロピル基のシクロプロパン環の還元的開環反応が効率よく進行した。一方、N-シクロブチルメチル基では、開環反応が全く進行せず、原料回収となった。
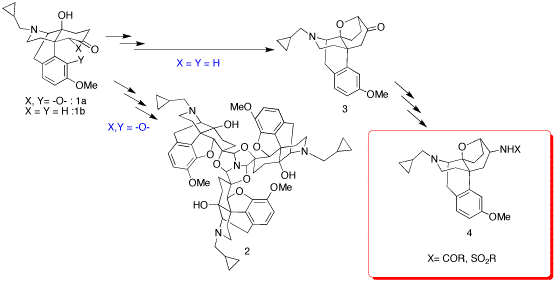
我々は既に4,5-エポキシ環を持つナルトレキソン誘導体1aを原料として合成したトリプレット薬2がモルヒネの20倍という非常に強い鎮痛効果を示すことを見出している1)。このトリプレット薬誘導体の研究過程において、4,5-エポキシ環を持たないモルヒナン誘導体1bを原料とした場合には、トリプレット体は全く得られず予想外の転位反応が進行し、オキサビシクロ[3.2.1]オクタン骨格を有する化合物3が得られることが当研究室で見出された2)。そこで化合物3の誘導体4を合成し、TRK-820(一般名:ナルフラフィン)並の活性とオピオイドκ選択性を向上した作動薬を合成することを目的に研究を行っている。
1) Nagase, H.; Watanabe, A.; Harada, M.; Nakajima, M.; Hasebe, K.; Mochizuki, H.; Yoza, K.; Fujii, H.
Org. Lett., 2009, 11, 539-542.
2) Watanabe, A.; Fujii, H.; Nakajima, M.; Hasebe, K.; Mochizuki, H.; Nagase, H.
Bioorg. Med. Chem. Lett., 2009, 19, 2416-2419.
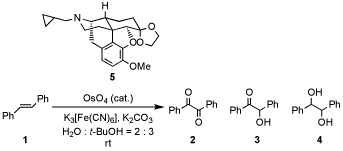
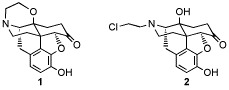
我々は既にOsO4によって第三級アミンからアミドアルコールとアミドケトンが生成される事を見出した。その過程で、ナルトレキソン誘導体5を不斉リガンドとして、スチルベン1の不斉ジオール化を試みたところ、予想に反してジケトン2が主生成物として得られた。OsO4とオレフィンとの反応では、ジケトン体までの酸化は副反応として報告されているのみであり、我々はOsO4によるスチルベン誘導体のジケトンへの酸化反応に興味を持ち、詳細に検討した。今後は、p位に様々な置換基を持つスチルベン誘導体を用いてOsO4酸化を行い詳細を検討していく予定である。
モルヒネに代表されるモルヒナン誘導体は17位置換基により活性が変化することが知られているが、そのメカニズムは知られていない。一般に14位が水酸基のモルヒナン誘導体の17位置換基はエクアトリアルに配向しているが、14位水酸基と17位置換基を分子内で結合した化合物1を合成することでアキシアルに固定し、活性を検討することにした。一方、17位にナイトロジェンマスタード様官能基を導入した化合物2(アジリジニウムイオン中間体をとり結合)も合成し、オピオイドμ受容体との不可逆的結合をさせることで受容体との相互作用を明確にする試みを通じてもその作動活性、拮抗活性の機構を解明する予定である。
我々はδ、κ受容体選択的化合物を目標とした研究の中で、モルヒナン1からプロペラン骨格3を合成することに成功した。このプロペラン骨格はモルヒナンと異なり側鎖結合部位が構造の上位にあることに興味を持ち、この骨格を基に合成を行うことにした。 一つのルートは、プロペラン型化合物3からBeckmann転位により環拡大化合物を得、7位に位置する窒素から誘導体合成をするものである。またカルボニル基のα位をカルボメトキシ化した化合物から、6位をトランスポジションした化合物の誘導体合成も行っている。
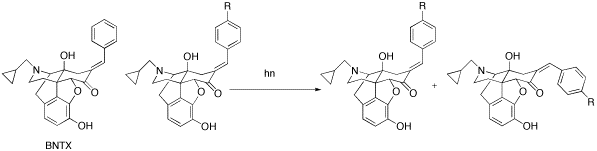
マラリアは世界3大感染症で、現在は温暖化の影響により流行域が北上しています。また、クロロキン等の抗マラリア薬に耐性をもつマラリア原虫の出現も大きな問題となっており、抗マラリア作用をもつ、または薬剤耐性解除作用をもつ新規薬物の創出が重要となってきました。 我々は、種々のオピオイド拮抗薬について、抗マラリア作用とクロロキンとの併用効果を検討したところ、オピオイドδ1受容体拮抗薬であるBNTX(トランス体)に、薬剤耐性マラリア原虫の薬剤耐性解除作用があることを発見しました。 そこで、さらなる作用増強とBNTXの作用機序解明をめざし、種々のBNTX誘導体の合成を行っております。誘導体合成の一環として、光化学反応によるBNTX誘導体の異性化(シス体へ変換)にも成功しました。
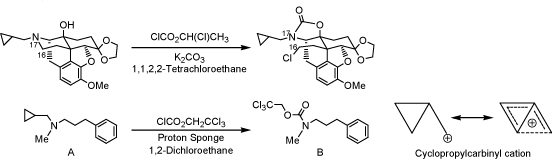
オピオイドε受容体リガンドの合成を試みる過程で、ナルトレキソン16-17位の新規切断反応を見いだした。モルヒナン骨格において16-17位を切断した例はなく、この切断反応を利用した新規オピオイド受容体リガンドの合成を試みている。また現在、第3級アミンの置換基変換の過程で上記化合物AにTrocClを反応させると、シクロプロピルメチル基がメチル基より優先的に切断され、Bが得られることを見出した。本反応はシクロプロピルカルビニルカチオンの安定化効果に起因すると考えられる。現在はこの反応の一般性についても検討中である。
第51回日本薬学会関東支部大会優秀研究発表賞受賞
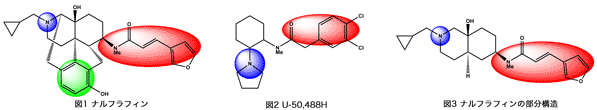
当研究室では世界で初めて依存性と薬物嫌悪性のないκ作動薬、ナルフラフィン(1)を腎透析の患者の難治性の止痒薬として開発し、2009年に市販した。一方、世界中の製薬会社はナルフラフィンの構造とは異なるU-50,488H(2)の誘導体を研究したが、嫌悪性が強くて開発を断念している。そこで、1と2の構造の違いを検討する過程で、ナルフラフィンの部分構造(3)の活性に興味を持ち、この誘導体を合成、活性相関を検討している。
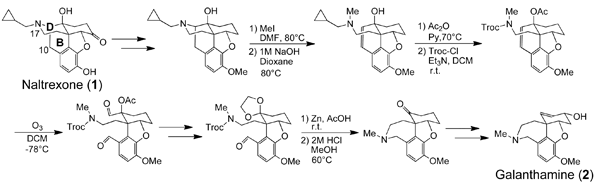
我々はオピオイドμ受容体拮抗薬であるナルトレキソン(1)が(-)-ガランタミン(2)と共通部分構造を有していることに着目し、ナルトレキソンのB環およびD環を切断し、N17-C10を結合させることで(-)-ガランタミン(2)がもつ7員環が構築できると考え、(-)-ガランタミン(2)の合成に着手し、その合成に成功した。
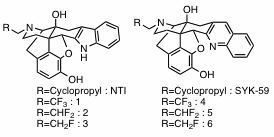
κ受容体選択的作動薬であるTRK-820、及びμ受容体選択的拮抗薬であるナルトレキソンの17位窒素にフッ素を有する置換基を導入するとそれぞれκ、μ受容体への親和性は置換基のフッ素の数に比例して低下するが、他の受容体への親和性は消失するため、結果的にκ、μそれぞれの受容体選択性が向上することがわかった。そこで、δ受容体リガンドにおける影響を見るため、δ受容体拮抗作用を有するNTI、SYK-59の17位窒素にフッ素を有する置換基を導入した化合物1-6を合成した。 今後は薬理評価を行い、同様に他のモルヒナン骨格を有する化合物についても合成する予定である。
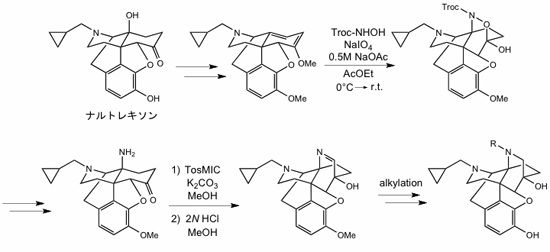
我々は、μ受容体拮抗薬であるナルトレキソンを原料としてC環がアザビシクロ[2.2.2]オクタン骨格を有する化合物を合成した。以前に当研究室ではオキサビシクロ[2.2.2]オクタン骨格を有する化合物が合成され、オピオイドκ受容体選択的リガンドとして見出されたことから、アザビシクロ[2.2.2]オクタン骨格を持つ化合物においても興味深い薬理活性が見られると期待できる。この化合物はヘテロDiels-alder反応とTosMICによるイミン体形成反応を鍵として合成された。今後はこの骨格を原料としてさらに誘導体を合成し、薬理評価を行っていく予定である。
今後は薬理評価を行い、同様に他のモルヒナン骨格を有する化合物についても合成する予定である。
1) Watanabe, Y.; Kitazawa, S.; Fujii, H.; Nemoto, T.; Hirayama, S.; Nagase, H.
Bioorg. Med. Chem. Lett., 2012, 22, 2689-2692.
当研究室ではδ、κ受容体選択的化合物を目標とした研究の中で、モルヒナン1からプロペラン骨格3を合成することに成功した。私はこのプロペラン骨格はモルヒナンと異なり側鎖結合部位が構造の上位にあることに興味を持ち、この骨格を基に側鎖を延ばし、δ、κ受容体選択性の薬物合成をしています。
1) Yamamoto, N.; Fujii, H.; Nemoto, T.; Nakajima, R.; Momen, S.; Izumimoto, N.; Hasebe, K.; Mochizuki, H.; Nagase, H.
Bioorg. Med. Chem. Lett., 2011, 21, 4104-4107.
2) Nagase, H.; Akiyama, J.; Nakajima, R.; Hirayama, S.; Nemoto, T.; Gouda, H.; Hirono, S.; Fujii, H.
Bioorg. Med. Chem. Lett., 2012, 22, 2775-2779.
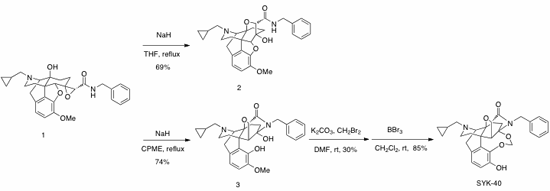
オピオイドκ受容体選択的作動薬として設計されたオキサビシクロ[2.2.2]オクタン骨格を有する4,5-エポキシモルヒナン誘導体2の合成の際、反応温度を制御することにより設計化合物2と予期せぬ転位生成物オキサアザトリシクロデカン構造を有する3を作り分けできることを見出した。得られた化合物3は中程度の親和性でオピオイド受容体に結合し、誘導体合成により更なる活性の向上が期待されたため、得られた化合物3の二つの水酸基をメチレンで架橋したSYK-40を合成した。SYK-40はオピオイドδ受容体に対して高い親和性および選択性を示したため、現在更なる活性と選択性の向上を志向して、本化合物をリード化合物とした誘導体合成を行っている。。
1) Nagase, H.; Watanabe, A.; Nemoto, T.; Yamaotsu, N.; Hayashida, K.; Nakajima, M.; Hasebe, K.; Nakao, K.; Mochizuki, H.; Hirono S.; Fujii, H.
Bioorg. Med. Chem. Lett., 2010, 20, 121-124.
2) Hayashida, K.; Fujii, H.; Hirayama, S.; Nemoto, T.; Nagase, H.
Tetrahedron, 2011, 67, 6682-6688.
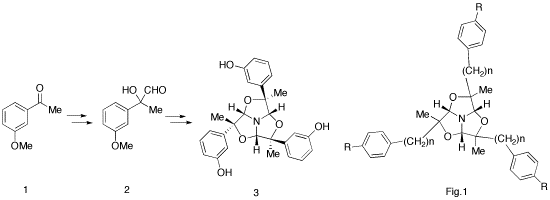
最近、当研究室において、1, 3, 5-トリオキサアザトリキナン骨格を持ったトリプレット薬の合成法を確立した。3つのα-ヒドロキシアルデヒドを窒素が繋いでいる様子が鎹(かすがい:Iron clamp)に似ていることから、我々はこれを窒素クランプ(Nitrogen clamp)による3分子固定と表現している。
そして、m-メトキシアセトフェノン1から合成した化合物3は、モルヒネ構造を持たないにも関わらず、μオピオイド受容体に高い結合活性を示した。このことから、窒素と芳香環の距離や配向性が重要であると考え、さらに、様々な受容体へ結合するための窒素と芳香環の距離や配向性が予測できるようになることを期待して、種々のスペーサーを導入したアセトフェノン誘導体のトリマーを合成した(Fig.1)。今後これらの薬理活性を検討する予定であり、また、併せてこれらのトリマーの光学分割も試みている。
1) Nagase, H.; Koyano, K.; Wada, N.; Hirayama, S.; Watanabe, A.; Nemoto, T.; Nakajima, M.; Nakao, K.; Mochizuki, H.; Fujii, H.
Bioorg. Med. Chem. Lett., 2011, 21, 6198-6202.
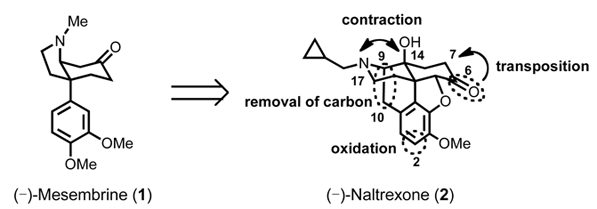
(-)-Mesembrine (1)は1957年にSceletium tortuosumより単離されたアルカロイドで、セロトニン再取り込み阻害作用を有することから、抗うつ薬のリード化合物として興味が持たれてきた。そのため、mesembrine (1)についてのエナンチオ選択的な合成を含む数多くの合成例が報告されている。一方、当研究室はオピオイドμ受容体拮抗薬である(-)- naltrexone (2)より種々の骨格変換をおこなうことで、オピオイドδ、κ受容体に対する高活性、高選択的な拮抗薬、作動薬の設計・合成をおこなってきた。今回、我々はオピオイド受容体に対する新規リガンドの探索として、(-)-naltrexone (2)と(-)- mesembrine (1)の共通部分構造に着目し、この変換を検討した。(-)-Naltrexone (2)から(-)-mesembrine (1)へ変換するためには、2位へのメトキシ基の導入、6位から7位へのケトンのトランスポジション、9,10位の炭素鎖の除去、14位と17位の窒素との縮環が必要である。現在、これらについて検討をおこなっている。
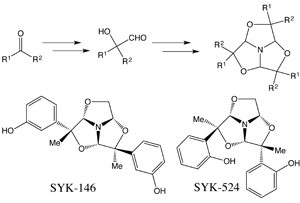
当研究室で確立した1,3,5-トリオキサアザトリキナン骨格を母骨格とするトリマー合成法を用い、o-、m-、p-アセトフェノンを出発原料として小規模ライブラリーを構築した。構築したライブラリーの中からオピオイドκ受容体選択的作動薬SYK-146とμ、δ、κ受容体に結合親和性かつ作動活性を示したSYK-524を言い出した。水素結合ドナーと各セプターの影響を検討するために側鎖がアニリン、ピリジンタイプのトリマーの合成を行っている。また、SYK-146の光学分割を行ったところ、(-)体が活性体であることが明らかとなったため、SYK-524の光学分割を検討している。
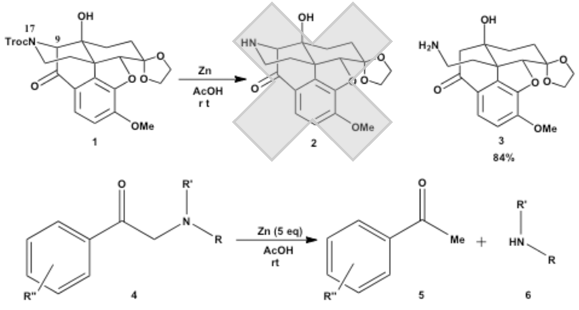
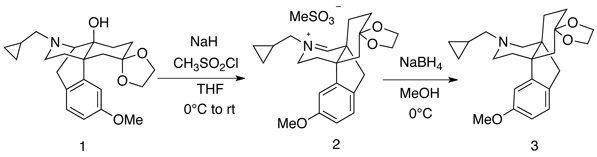
当研究室において、化合物1の17位窒素のTroc基を亜鉛-酢酸条件下、脱保護しようとしたところ、目的の化合物2は得られず、9位炭素、17位窒素間の結合が切断された、予期せぬ化合物3が得られた。そこで、α-アミノケトンの亜鉛-酢酸による還元的開裂反応の過去の報告例を調査したところ、単純な第一、二、三級アミノケトンの例は見当たらなかった。よって、この反応を新規反応と考え、基質の一般性を検討している。
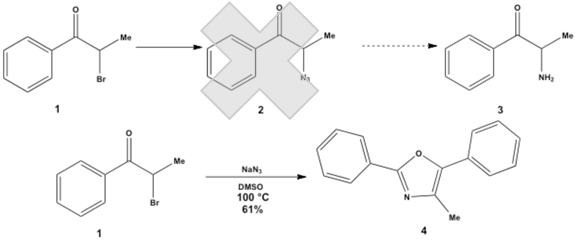
亜鉛-酢酸による還元的開裂反応の検討過程において、化合物1をナトリウムアジドと反応させ、続くアジド基の還元によりα-アミノケトン3とし、同様の反応を行おうと試みたが、アジド化の際に、アジド化合物2ではなく、予期せぬオキサゾール4が得られた。既知のオキサゾール合成法とは、生成物の構造や反応条件が異なることから、本反応をオキサゾールの新規合成法と考え、反応の適応範囲と、反応機構の検討を行っている。
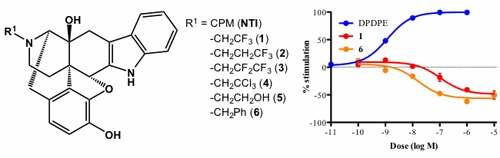
選択的オピオイドδ受容体アンタゴニストであるNTIの17位窒素置換基を変換した化合物1〜6のGTPγS結合試験を行ったところ、化合物1および化合物6は、インバースアゴニスト活性を示した。
現在、オピオイドκ受容体およびμ受容体アンタゴニストにおいても誘導体合成を行い、インバースアゴニスト活性について検討している。