2.感染症を制御する化合物の機能解析
製薬企業では、大型新薬が期待できる生活習慣病などの慢性疾患に焦点を当てた創薬研究が中心に進められており、感染症からの創薬開発は後回しとなっています。こうした現状を考えると大学での感染症分野における創薬研究の重要性は高まっておりかつ大学の担う役割は大変大きいものと言えます。また近年、これまで用いてきた抗生物質が効かなくなった耐性菌が出現し社会問題となっており、従来の治療薬とは異なる作用メカニズムを有する新薬の開発および新しい治療法の開発が求められています。私たちグループでは、感染症の中でも、例えば、結核症(三大感染症の一つであり年間死亡者が 200 万人以上と推定)やメチシリン耐性黄色ブドウ球菌 MRSA 感染症(有効な治療薬がほとんどなく重篤な院内感染症)といった特に問題となっている疾患に焦点を当てています。こうした感染症に有効な化合物の検索を、独自の発想をもとに構築した評価系を用いて実施し、いくつかの有望な候補化合物をこれまでに発見してきました。その中でも、特色ある抗感染症活性を有する2種の化合物(シスラブダンとラリアチン)の作用機序の研究についてご紹介します。
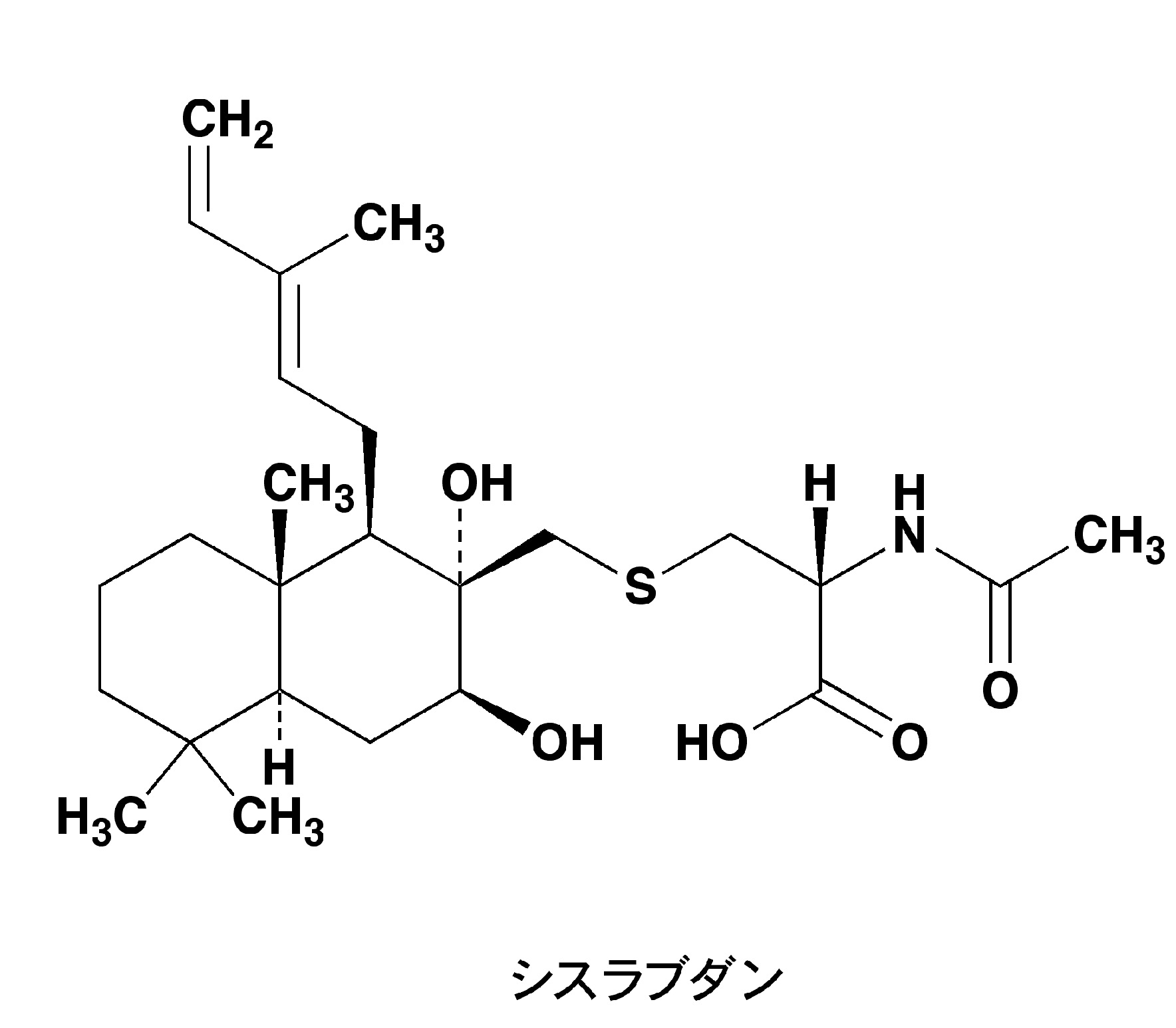
シスラブダン
既存の抗生物質であるβ-ラクタム系抗生物質の抗 MRSA 活性を1000倍以上増強させ、感受性菌と同程度にまでその活性を回復させる興味深い活性をもつ化合物です。シスラブダンは、ラブダンジテルペン骨格にチオエーテルを介して N-アセチルシステインが結合したユニークな構造を特徴としています。このラブダンジテルペン骨格をもつ化合物は、植物の代謝産物としてのみ報告されており、放線菌からの発見は初めてでありました。
同活性物質としては、ステンフォン類が既に発見されていますが、共通のジテルペン部位をもつ特徴から、標的分子は同じであると予想しています。さらに、予備的な研究からは、耐性機序として報告されているペニシリン結合タンパク質(PBP2’)あるいはβ-ラクタマーゼには影響しないことが分かってきました。最近では、MRSA 耐性に関わる因子は種々報告されてきています。現在、そうした別の耐性因子への影響を調べる研究にくわえて、ビオチン標識体を用いて細胞内の結合分子を特定することで、標的分子を証明しようと考えています。将来的に、こうした研究成果が抗感染症薬開発のための新規標的分子の開拓や創薬リード開発につながることを期待しています。
ラリアチン
結核菌Mycobacterium tuberculosis H37Rv に強い抗菌活性を示すのに対して、他の細菌類にはほとんど作用せず、結核菌にのみ有効なことが分かっています。その構造も大変ユニークなもので、N 末端 8 残基目の Glu の側鎖カルボン酸が Gly とアミド結合で環化し、この環をC 末端が通り抜けた特異な「投げ縄構造」を有しています。活性の特色から、結核菌に特有な標的が予想されており、ミコール酸などの結核菌に特有な標的分子への作用を解析するとともに、ラリアチン耐性菌を用いた遺伝子工学的手法を中心に解析を進めています。こうした研究とともに、放線菌におけるラリアチン類の生合成機構の解析も遺伝子レベルで進めています。その生合成機構の解明によって、動物実験に供するためのラリアチンの大量取得が可能となり、またアミノ酸の部位変異を施した種々の変異ペプチドの調製することで活性に重要なファーマコフォアの特定にもつながることが期待されています。

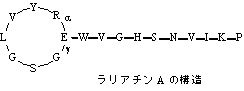
これら機能分子の他にも、我々が発見した抗感染症活性を有する化合物はまだ多くあり、それらについても作用機序の解析を随時進めています。北里では、これまでの長い歴史において、キタサマイシンやマイトマイシンCなどの数多くの抗生物質を発見し創薬へと応用してきた実績があります。医薬品誕生までの道のりは確かに険しいですが、一歩一歩着実に研究を重ね、本稿でも紹介してきた化合物についても、その作用メカニズムが理解されることで医薬品開発へと発展し、将来、感染症疾患で苦しむ人々の治療に貢献することを夢見て日々の研究を行っております。